تم إعداد هذه الأسئلة والأجوبة بواسطة نخبة من العلماء والمختصين في مجال اللقاحات والتطعيم في العالم
Sonali Kochhar, MD1, Eve Dubé, PhD2, Janice Graham, PhD3, Youngmee Jee MD, PhD4, Ziad A. Memish, MD5, Lisa Menning6, Hanna Nohynek, MD, PhD7, Daniel Salmon, PhD8; Karina Top, MD, MS9, Noni E MacDonald, MD10
تمت الترجمة والمراجعة اللغوية بواسطة فريق مبادرة تطعيم وعضو من اللجنة الإستشارية للمبادرة بطلب من شبكة سلامة اللقاحات التابعة لمنظمة الصحة العالمية لصالح موقع كانفاكس الكندي والذي تتم إدارته بواسطة الجمعية الكندية للصحة العامة
التجارب السريرية
سونالي كوشهار(Sonali Kochhar) وفريق سؤال وجواب عن لقاحات الكوفيد-19
تتكون لقاحات الحمض النووي الريبوزي المرسال (mRNA) من قطع اصطناعية من رسالة RNA مغلفة بجزيئات النانو الدهنية التي تعمل علي توصيلها إلى الخلية المضيفة. لقاحات mRNA ليست لقاحات فيروسية حية، وجزيئات النانو الدهنية لها تأثير على استقرار و تحفيز المناعة بواسطة اللقاح ولا تستخدم اللقاحات مادة مساعدة إضافية لتعزيز فعالية اللقاح. 1 لقاحات mRNA لا تدخل النواة ولا يمكن دمجها في الحمض النووي البشري أو إحداث تغييرات في الحمض النووي البشري لمتلقي اللقاح. 1,2.3,4
بعد الحقن في العضلة العلوية للذراع، ستعطي لقاحات ال mRNA تعليمات للخلايا لصنع قطعة غير ضارة من البروتين تسمى “البروتين الشوكي”. البروتين الشوكي موجود على سطح الفيروس المسبب لـلكوفيد-19. بعد تصنيع قطع البروتين، تقوم الخلايا بتفكيك mRNA (وهو عبارة عن تعليمات لصنع البروتين) أي يحدث تحللًا طبيعيًا للقاح في غضون أيام. 1,2.3
يتم اظهار قطع البروتين على سطح الخلية. يدرك الجهاز المناعي أن البروتين لا ينتمي إلى الخلية ويبدأ في صنع الأجسام المضادة وبناء استجابة مناعية (أي أن هناك تحفيزًا لكل من الخلايا البائية والتائية)، تمامًا مثل ما يحدث بعد العدوى الطبيعية ضد الكوفيد-19. يتعلم الجسم حماية نفسه من عدوى الكوفيد-19 المستقبلية دون التعرض لخطر العواقب الوخيمة لعدوى الكوفيد-19.
يعتبر الحمض النووي الريبوزي المرسال (mRNA) بطبيعته ناقل آمن للقاح لأنه سريع الزوال وناقل ضئيل للمعلومات التي لا تتفاعل مع الحمض النووي لمتلقي اللقاح. إن الافتقار إلى التكامل الجيني بجانب أن mRNA غير قابل للإستنساخ ويتحلل بشكل استقلابي في غضون أيام قليلة يجعل من mRNA ناقلًا آمنًا للمعلومات وسريع الزوال .2,3
تمت دراسة لقاحات mRNA من قبل، بما في ذلك لقاحات مراض زيكا وداء السعر والإنفلونزا والفيروس المضخم للخلايا. استخدمت أبحاث السرطان أيضًا mRNA لتحفيز الجهاز المناعي لاستهداف خلايا سرطانية معينة. في المستقبل، قد تسمح تقنية mRNA للقاح واحد لتوفير الحماية ضد أمراض متعددة، وبالتالي تقليل عدد الحقن المطلوبة للحماية من هذه الأمراض المتعددة. تتيح عمليات التصنيع السريعة لل mRNA وتركيب جزيئات النانو الدهنية القابلتين للتطوير بدرجة عالية، الإنتاج السريع للعديد من جرعات اللقاح. وهذا يجعل لقاحات mRNA مناسبة للتطوير السريع للقاحات عند ظهور جائحة. توفر لقاحات mRNA أقصى قدر من المرونة في عملية التطوير حيث يمكن لجسم الإنسان التعبير عن أي بروتين من mRNA دون الحاجة إلى تعديل عملية الإنتاج. 3
بالنظر إلى تركيب لقاحات mRNA ، هناك حاجة إلى التخزين والتعامل الدقيقين للغاية لضمان استقرار mRNA. على سبيل المثال: يجب تخزين لقاح شركتي فايزر وبايونتك بين سالب 80 درجة مئوية إلى سالب 60 درجة مئوية (سالب 112 درجة فهرنهايت إلى سالب 76 درجة فهرنهايت) و بعد الذوبان والتخفيف قبل الإعطاء يجب تخزينه بين 2 درجة مئوية إلى 25 درجة مئوية (35 درجة فهرنهايت إلى 77 درجة فهرنهايت) ويستخدم في غضون 6 ساعات من وقت التخفيف. يمكن تخزين لقاح شركة موديرنا في درجة حرارة سالب 20 درجة مئوية (سالب 4 درجة فهرنهايت)، أي ما يعادل معظم درجات حرارة الثلاجات أو الفريزرات الطبية ، لمدة تصل إلى 6 أشهر وبعد الذوبان، عند 2 درجة إلى 8 درجات مئوية. (36 درجة إلى 46 درجة فهرنهايت) لمدة تصل إلى 30 يومًا خلال فترة الصلاحية البالغة 6 أشهر. قد تعمل التكنولوجيا بمرور الوقت على التغلب على هذه المشكلة ولكن في الوقت الحالي، هذا قد يحد من الوصول والاستخدام في العديد من الأماكن حيث تمثل الفريزرات شديدة البرودة وحتى الوصول إلى سالب 20 درجة مئوية مشكلة. لقاحات mRNA هي تقدم كبير في علم اللقاحات وسيغير المجال بمرور الوقت.
المراجع
- Understanding mRNA COVID-19 Vaccines. Centres for Disease Control and prevention. Nov. 23, 2020. Accessed on 14 Dec 2002 at https://www.cdc.gov/coronavirus/2019-ncov/vaccines/different-vaccines/mrna.html
- Advances in mRNA Vaccines for Infectious Diseases. Zhang C, Maruggi G, Shan H, Li J. Front Immunol. 2019;10:594. doi: 10.3389/fimmu.2019.00594.
- Developing mRNA-vaccine technologies. Schlake T, Thess A, Fotin-Mleczek M, Kallen KJ. RNA Biol. 2012; 9(11):1319-1330. doi:10.4161/rna.22269
- mRNA vaccines – a new era in vaccinology. Pardi N, Hogan MJ, Porter FW, Weissman D. Nat Rev Drug Discov. 2018;17(4):261-279. doi:10.1038/nrd.2017.243
إيف دوبي (Eve Dubé) وفريق سؤال وجواب
على عكس الأدوية التي تُعطى للمرضى للعلاج ، تُعطى اللقاحات للأشخاص الأصحاء للوقاية من المرض. وبالتالي ، تتطلب اللقاحات عادة إثباتا قاطعا على سلامتها مقارنة بالأدوية العلاجية و ذلك قبل استخدامها. يخضع تطوير اللقاح لمجموعة صارمة من العمليات والإجراءات العلمية والأخلاقية المنفذة بعناية لضمان سلامة وفعالية اللقاحات قبل إعطائها لعدد كبير من الأشخاص (يمكنك الاطلاع على نظام سلامة اللقاحات الكندية1، وتُستخدم أساليب مشابهة جدًا في العديد من البلدان الأخرى).
أولاً ، يتم تقييم سلامة اللقاح والقدرة المناعية (أي قدرة اللقاح على إنتاج استجابة مناعية) في الدراسات ما قبل السريرية باستخدام زراعة الأنسجة أو زراعة الخلايا أو الحيوانات المعملية (على سبيل المثال ، الاختبارات مع الفئران أو القوارض أو القرود). إذا نجحت الدراسات قبل السريرية (في السلامة والمناعة)، يتم إجراء الدراسات السريرية على البشر. في كل مرحلة ، يتم تقييم نتائج الدراسات والتجارب من قبل الجهات التنظيمية الحكومية لمنح الإذن بالانتقال إلى المرحلة التالية.
تشمل تجارب المرحلة الأولى مجموعة صغيرة من البالغين (بشكل عام بين 20-100 متطوع سليم) وتهدف إلى تقييم سلامة اللقاح ونوع ومدى الاستجابة المناعية. إذا لم يتم تحديد أي مشاكل خلال المرحلة الأولى ، فإن اللقاح التجريبي ينتقل إلى تجارب المرحلة الثانية التي تشمل عدة مئات من الأفراد. الهدف من تجارب المرحلة الثانية هو تقييم سلامة اللقاح ، والقدرة المناعية ، والجرعات ، والجدول الزمني. إذا نجحت ، يتم إجراء تجارب المرحلة الثالثة الأكبر وسط آلاف إلى عشرات الآلاف من الأشخاص لتقييم الفعالية ولمزيد من تأكيد سلامة اللقاح.
هذه تجارب عشوائية ومزدوجة التعمية حيث يتم إختبار اللقاح المرشح و مقارنته مع لقاح اخر أو دواء فاقد الفاعلية (عادة مادة خاملة ، مثل حقنة ملحية). تسمح تجارب المرحلة الثالثة بإكتشاف الآثار الجانبية النادرة التي غالبًا لا يتم تحديدها في تجارب المرحلة الأولى أو المرحلة الثانية (على سبيل المثال ، تحدث في أقل من 1 إلى 10 لكل10000) 2.
بعد ذلك، من هذه التجارب يتم تقييم المعلومات المتعلقة بسلامة اللقاح وفعاليته من قبل الجهات التنظيمية الحكومية المستقلة عن الباحثين الذين أجروا التجارب أو الشركات المصنعة للقاح. غالبًا ما يقوم الخبراء غير الحكوميين بمراجعة البيانات أيضًا. بعد مراجعة البيانات بعناية والموافقة عليها من قبل المنظمين ، يمكن استخدام اللقاح في ذلك البلد. تظل سلامة اللقاح قيد المراقبة بمجرد الموافقة على اللقاح من خلال التقصي النشط والسلبي (حيث يتم تلقي معلومات عن سلامة اللقاحات أيضا من الأطباء أثناء الممارسة الروتينية اليومية) لضمان تحديد المخاطر المحتملة للآثار الجانبية النادرة جدًا المرتبطة باللقاح (بالإشارة إلى السؤال الأخير في القسم الخاص بالتأثير طويل المدى).
يتبع تطوير لقاح الكوفيد-19 هذه المعايير، من تطوير اللقاحات بسرعة ( بالإشارة إلى السؤال 4) 3. تم تطوير العديد من لقاحات الكوفيد-19 باستخدام الأساليب والتقنيات التي أثبتت أنها آمنة مع اللقاحات أو الأدوية الأخرى في الماضي، بينما يستخدم آخرون تقنيات جديدة. كما هو الحال مع جميع اللقاحات الجديدة، سيتم تكريس مزيد من العناية والإهتمام لسلامة اللقاح.
المراجع
MacDonald NE, Law BJ. Canada’s eight-component vaccine safety system: A primer for health care workers. Paediatrics & Child Health, 2017, e13-16 Online: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5825834/pdf/pxx073.pdf Page Accessed September 28, 2020
Vaccine Testing and Approval Process. Centers for Disease Control and Prevention. Online: https://www.cdc.gov/vaccines/basics/test-approve.html Page Accessed on September 25, 2020
Accelerating a safe and effective COVID-19 vaccine. World Health Organization. Online: https://www.who.int/emergencies/diseases/novel-coronavirus-2019/global-research-on-novel-coronavirus-2019-ncov/accelerating-a-safe-and-effective-covid-19-vaccine Page Accessed on September 25, 2020
جانيس جراهام (Janice Graham) وفريق سؤال وجواب
تساعد الإجراءات المكثفة (مثل القوانين واللوائح والمبادئ التوجيهية) في ضمان أن اللقاحات المعتمدة من قبل السلطات المنظمة الوطنية، مثل إدارة الغذاء والدواء الأمريكية ، وزارة الصحة الكندية، ووكالة الأدوية الأوروبية ، آمنة وفعالة. تشرف الهيئات المنظمة الوطنية على الموافقة على التجارب السريرية وتقيم الأدلة بعناية قبل إعتماد أى لقاح أو دواء أو جهاز علاجي في بلدانهم. تحدد اللجان المعنية بأخلاقيات البحوث ما إذا كانت بروتوكولات التجارب السريرية تفي بالمعايير الأخلاقية لموافقة المشاركين في التجربة، وقدرتهم على اتخاذ القرار، وإجراء التجربة، والإنصاف والمساواة في المشاركة في البحث، والخصوصية والسرية، ومعالجة تضارب المصالح، ومراقبة السلامة والإبلاغ، و التسجيل (على سبيل المثال ، هيئة المجلس الثلاثي الكندية المعنية أخلاقيات البحث). الهيئات الدولية مثل المؤتمر الدولي لتنسيق المبادئ التوجيهية للممارسات السريرية الجيدة، تشرف على البحوث في البشر والالتزامات التنظيمية للسلامة والفعالية والجودة1.
تحتوي كل تجربة سريرية على مجلس مراقبة سلامة البيانات والذي يقوم بتقييم البيانات المؤقتة على فترات زمنية محددة مسبقًا أثناء التجربة. يتم إيقاف التجارب مؤقتًا عند وقوع حدث غير مرغوب فيه ويمكن إيقافها تمامًا إذا اعتُبر استمرارها غير مستحق. تقوم منظمة الصحة العالمية بتنسيق لجان إستشارية للخبراء للتداول بشأن مسائل الصحة العالمية وتوفر التوجيه الأخلاقي وتعمل مع الهيئات المنظمة الوطنية لترخيص اللقاحات الآمنة في البلدان منخفضة الدخل. تشجع منظمة الصحة العالمية البلدان على أن يكون لديها مجموعة إستشارية فنية وطنية مستقلة للتطعيم لمراجعة بيانات اللقاح المعتمدة فيما يتعلق بالأوبئة المحلية لتحديد المستهدفين لتلقى اللقاح. تقوم هذه المجموعات الفنية الإستشارية ببناء القدرات لممارسة معايير سلامة اللقاحات العالمية2,3.
تعتبر الشفافية طوال فترة ما قبل الموافقة على اللقاح أمر بالغ الأهمية للسلامة وثقة العامة، بما في ذلك مراجعة جميع بروتوكولات التجربة، وجميع البيانات والوثائق الفنية، وتقارير الدراسة السريرية وقواعد التوقف، وعمليات صنع القرار4,5 . يمكن للاحتياجات الاستثنائية للبحوث العاجلة أثناء حالات الطوارئ الصحية العامة أن توجه الى مراجعة المسائل الأخلاقية وأن تنشئ تفويضات للهيئات المنظمة الوطنية لتسريع المسارات التنظيمية للتجارب السريرية، والنظر في الموافقات المشروطة و / أو إصدار إذن الاستخدام في حالات الطوارئ. على الرغم من بعض الضغوط السياسية، قاومت الهيئات المنظمة الوطنية في كندا والولايات المتحدة وأوروبا اتباع طرق مختصرة. تتطلب الموافقة السريعة اليقظة لضمان عدم المساس بالسلامة6,7,8.
المعايير التنظيمية والقانونية تحد من تضارب المصالح، وتفرض جودة التصنيع، والإبلاغ عن الأحداث السلبية الخطيرة بعد التطعيم يضمن السلامة. لغرس الثقة في أن لقاحات الكوفيد-19 المستعجلة ستكون آمنة، يحتاج عامة الناس إلى ضمان:
1/ مبادئ توجيهية واضحة لتقديم الإقرارات و التي تستبعد الأشخاص الذين لديهم تضارب مصالح (شخصية ومهنية) من المشاركة في القرارات؛
2/ الشفافية وإتاحة الوصول بدون تقييد الى جميع بروتوكولات التجارب والبيانات (بما في ذلك مكونات اللقاح مثل المواد المحفزة للمناعة) والتعديلات والتحويرات التي تمت وعمليات صنع القرار والأسباب المنطقية؛
3/ لا يوجد خطر متزايد على المشاركين من التعديلات التي تم إجراؤها في التجارب المحورة التي تضغط على مراحل الاختبار أو لاضافة أذرعًا جديدة كاستجابةً للنتائج الجديدة. وكما يقول التحالف العالمي للقاحات والتحصين ” هذه التغييرات ليست تخمينًا – فهي تستند إلى قواعد محددة بوضوح وضعها العلماء الخبراء في تقييم الغموض أو عدم اليقين”9 ، 9 يجب أن تكون هذه التعديلات التى تمت معروفة على الفور ، أي شفافة، مع وجود أساس منطقي وبيانات / أدلة تدعم تلك القرارات.
4/ تقييم مستقل لجميع أدلة التجارب السريرية ومبررات اتخاذ القرارات وتوصيات اللجنة الاستشارية والترويج للقاح لمعالجة تصور تضارب المصالح ؛
5/ تجارب مدعومة بشكل كاف لضمان السلامة والفعالية. يمكن أن تفوت تجارب المرحلة الثالثة آثارا جانبية نادرة (معدل حدوثها ≥ 0.01٪ و <0.1٪) ولكنها خطيرة إذا كانت أعداد المشاركين في التجربة صغيرة.. تعد مجموعات التجارب الكبيرة مهمة في تحديد الآثار الجانبية النادرة والنادرة جدًا ولكنها تبقى خطيرة في نفس الوقت و يمكن أن تؤدي إلى المرض (على سبيل المثال ، الانغلاف المعوي كما في حالة لقاح الروتا)؛
6/ يجب أن يتواصل الإشراف بعد الموافقة والمراقبة والتقصى بفعالية للكشف عن الأحداث السلبية النادرة جدًا والخطيرة بعد التطعيم وكذلك الكشف عن فشل اللقاح ؛
7/ الوقاية من المرض هو الخيار الأعلى قيمة بدلاً عن البدائل العلاجية (مثل استخدام المصل)؛
8/ يعتبر تحديد موقع تجارب المرحلة الثالثة في المناطق التي ينتشر فيها المرض أمرًا بالغ الأهمية للتعرض للمرض ولتحديد الوقاية منه ؛
9/ مع عدم وجود علاجات متوفرة لـلكوفيد-19 ، تعتبر تجارب التحدي البشري الحالية غير أخلاقية ؛
10/ المشاركة المنصفة في البحوث الخاصة بالمجتمعات الممثلة تمثيلا ناقصا والمعرضة لخطر الإصابة بأمراض خطيرة ، مثل كبار السن ، والجماعات العرقية / الإثنية ، والحوامل والأشخاص الذين يعانون من نقص المناعة.
المراجع
- Dixon, J.R. The International Conference on Harmonization Good Clinical Practice guideline. Quality Assurance 1998; 6(2):65-74. doi: 10.1080/105294199277860.
- Graham, J.E, Borda-Rodrigeuz, A., Huzair, F., & Zinck, E. Capacity for a global vaccine safety system: The perspective of national regulatory authorities. Vaccine, 2012; 30(33), 4953-4959. doi:10.1016/j.vaccine.2012 .05.045.
- Harmon, S.H.E., Faour, D.E., MacDonald, N.E., Graham, J.E., Steffen C., Henaff L, Shendale S., the Global NITAG Network Survey Correspondents. Immunization governance: Mandatory immunization in 28 Global NITAG Network countries. Vaccine https://doi.org/10.1016/j.vaccine.2020.09.053
- Morten C.J., Kapczynski A, Krumholz HM, Ross, J.S. To help develop the safest, most effective coronavirus tests, treatments, and vaccines, ensure public access to clinical research data. Health Affairs Blog, March 26, 2020. https://www.healthaffairs.org/do/10.1377/hblog20200326.869114/full/
- Herder, Matthew and Janice E. Graham. Opinion: Herder and Graham: Canadians need and deserve transparency on COVID-19 vaccines. Ottawa Citizen Sept 15, 2020. https://ottawacitizen.com/opinion/herder-and-graham-canadians-need-and-deserve-transparency-on-covid-19-vaccines
- Graham, J.E. Smart Regulation: Will the government’s strategy work? Canadian Medical Association Journal 2005;173(12),1469-1470. doi: 10.1503/cmaj.050424. Retrieved from https://www.cmaj.ca/content/173/12/1469.short
- Graham, J.E., & Nuttall, R. Faster Access to New Drugs: Fault Lines Between Health Canada’s Regulatory Intent and Industry Innovation Practices. Ethics in Biology, Engineering & Medicine – An International Journal 2013;4(3),231-239. doi: 10.1615/EthicsBiologyEngMed.2014010771. (http://hdl.handle.net/10222/75934)
- Doshi, P. Pandemrix vaccine: why was the public not told of early warning signs? BMJ 2018;362:k3948 doi: 10.1136/bmj.k3948.
- GAVI. Can vaccine clinical trials be sped up safely for COVID-19? https://www.gavi.org/vaccineswork/how-covid-19-leading-innovation-clinical-trials
حنا نوهاينك(Hanna Nohynek) وفريق سؤال وجواب
أصيب أحد المشاركين في الدراسة بضعف في الذراعين والساقين بعد التطعيم ، وتم إجراء تشخيص مؤقت لالتهاب النخاع المستعرض، وهو متلازمة التهابية تصيب النخاع الشوكي .عندإجراء المزيد من التقييم ، اتضح بأن مشاركًا آخر قد تم تشخيصه بمرض التصلب المتعدد ، والذي تم اعتباره أيضًا غير مرتبط بلقاح الكوفيد-19 1 . في التجارب الكبيرة مع عشرات الآلاف من المشاركين ، هذه الأنواع من التوقف المؤقت ليست أمرا غير مألوف. يمكن أن تحدث الأمراض عن طريق الصدفة ولكن يجب مراجعتها بشكل مستقل لتوضيح ما إذا كانت مرتبطة بالدواء أو اللقاح قيد الدراسة أم لا. في هذه الحالة ، توصل الخبراء المستقلون إلى نتيجة مفادها أن اللقاح لم يتسبب في هذه الأحداث ، وسُمح للدراسة بالمواصلة في تجنيد مشاركين في المملكة المتحدة وجنوب إفريقيا والبرازيل واليابان والولايات المتحدة.
المراجع
- AstraZeneca and J&J get go-ahead to resume Covid-19 vaccine trials. Accessed on October 26, 2020 at https://www.ft.com/content/2d2d0e8c-3560-456f-bf3e-59a869e6aa00
إدخال اللقاحات الى البلدان
نوني ماكدونالد (Noni E MacDonald) وفريق سؤال وجواب عن لقاحات الكوفيد-19
في حين أن تجارب المرحلة الرابعة بعد الموافقة على لقاح الكوفيد-19 (تجارب مراقبة ما بعد التسويق) مطلوبة في العديد من البلدان من قبل السلطات المنظمة الوطنية التي وافقت على اللقاحات، فإن هذه التجارب غالبًا لا تكون كبيرة بما يكفي لاكتشاف فشل اللقاح، ونادرا ما تكون هنالك أحداث سلبية خطيرة جدًا منسوبة إلى اللقاحات.
تشمل المساهمات الرئيسية لأخصائيي الرعاية الصحية في الخطوط الأمامية (HCP) في تحديد فعالية اللقاح وسلامته:
أ) الكشف عن حالات فشل اللقاح:-
– بينما توفر تجارب المرحلة الثالثة بيانات عن فعالية اللقاح (أي الحالات في مجموعة متلقي لقاح الكوفيد-19 مقابل الحالات في المجموعة التى لم تاخذ لقاح الكوفيد-19)، فإن هذه الدراسات لا تعطي بيانات عن الأداء “الحقيقي” لهذه اللقاحات، أي الفعالية في الظروف الحقيقية لعامة الناس. قد يتأثر الأداء الحقيقي للقاح بالعديد من العوامل بما في ذلك العمر، ووجود الظروف الصحية الأساسية، والسياق ، والجنس، والأدوية ،التغذية والتزام برنامج التحصين بمتطلبات التخزين والتسليم على سبيل المثال لا الحصر. ومن ثم، بمجرد الموافقة على لقاح الكوفيد-19، نحتاج إلى معرفة مدى نجاحه في “العالم الحقيقي” عبر مجموعة واسعة من الأشخاص الذين يحتاجون إلى التطعيم لحماية أنفسهم ومجتمعاتهم.
بمجرد استخدام لقاحات الكوفيد-19 في أي بلد، يحتاج مقدمو الرعاية الصحية في الخطوط الأمامية إلى التحقق من جميع المرضى الذين يقدمون نتائج سريرية تشير إلى الإصابة بعدوى الكوفيد-19 لتحديد ما إذا كانوا قد تلقوا لقاح الكوفيد-19 وإذا كان الأمر كذلك، كم كان عدد الجرعات ومتى تم أخذ كل منها. يمكن القيام بذلك عن طريق التحقق من سجل التطعيم الوطني إن وجد، والسجلات الصحية للمريض وأيضًا عن طريق سؤال المريض مباشرة. إذا تلقى المريض لقاح الكوفيد، فيجب التحقق من تشخيص عدوى الكوفيد ليس من خلال النتائج السريرية ولكن من خلال اختبار قياسي ذهبي قاطع مثل اختبار تفاعل البوليميراز المتسلسل في الوقت الفعلي (RT-PCR) لمواد الجهاز التنفسي أثناء الأسبوع الأول من الأعراض1,2 . يمكن استخدام إختبارات مراكز الرعاية السريعة ولكن يفضل استخدام RT-PCR لتقليل مخاطر الاختبار الإيجابي الكاذب، وهو أحد المخاوف التي أبرزتها إدارة الغذاء والدواء الأمريكية (https://www.fda.gov/medical-devices/letters-health-care-providers/potential-false-positive-results-antigen-tests-rapid-detection-sars-cov-2-letter-clinical-laboratory).
بالنسبة إلى لقاحات الكوفيد-19 التي تستخدم البروتين الشوكي، فإن الاختبار المصلي الروتيني لا يساعد في تأكيد تشخيص الكوفيد-19 بسبب تاريخ التطعيم الإيجابي لـلكوفيد-19 مطلوب فحص الأجسام المضادة للبروتين المغطي لنواة الفيروس. إلى جانب توفير الرعاية للمريض، يحتاج مقدم الرعاية الصحية إلى إبلاغ جهات الصحة العامة بحالات فشل اللقاح المشتبه بها لمتابعة التحقيق لتحديد ما إذا كان قد حدث بالفعل فشل في اللقاح ولماذا. التفاصيل مهمة لتحديد الأداء الفعلي للقاح الضالع بالاجابة على:
- هل يرجع الفشل مباشرة إلى اللقاح المحدد أو بسبب التخزين / المناولة أو اللقاح المخفف أو خطأ آخر في البرنامج؟ ما هي الإجراءات المحددة؟
- هل هناك أسباب سريرية أساسية قد تكون غيرت من استجابة هذا المريض للقاح المحدد؟
- هل تظهر حالات الفشل بين الآخرين الذين تلقوا هذا اللقاح المحدد خلال نفس الفترة الزمنية، أو مجموعة فرعية مماثلة من السكان ، إلخ؟ في بلدك؟ في بلادهم أو في بلدان أخرى؟
- هل هناك دليل على تراجع الحماية بمرور الوقت؟ هل يختلف هذا حسب العمر أو المجموعة الفرعية أو بعوامل أخرى؟
مع تراكم حالات فشل اللقاح، يمكن رؤية اختلافات في الفعالية مع اللقاحات المختلفة في مختلف الأعمار والمجموعات الفرعية والبيئات. هذه المعلومات مهمة محليا ووطنيا وعالميا. اعتمادًا على النتائج قد يحتاج تعديل التوصيات الخاصة باستخدام اللقاح المحدد إلى تعديل لمختلف الفئات العمرية و المجموعات الفرعية على سبيل المثال المزيد من الجرعات، والفترات الزمنية المختلفة، والحاجة إلى جرعات معززة، وما إلى ذلك بالإضافة إلى القدرة على تقديم نصائح أكثر تحديدًا حول الفترة الفاصلة بين تلقي جرعات اللقاح والحماية.
ب) الكشف عن الأحداث السلبية النادرة جدًا والخطيرة بعد التطعيم
تقييم سلامة أي لقاح جديد هو عملية معقدة3 . قد تظهر المخاوف الفردية والمجتمعية لقبول اللقاحات عندما يتم الإبلاغ عن الأحداث السلبية بعد التطعيم في وسائل الإعلام العامة، وحين لا توجد معلومات كافية تقدمها السلطات والخبراء بشأن الحدث والخطوات التي يتم اتخاذها لفهم الاسباب بشكل أفضل.
– الحدث السلبي بعد التطعيم هو “أي حدث طبي غير مرغوب فيه يعقب التطعيم وليس بالضرورة أن يكون له علاقة سببية باستخدام اللقاح. والحدث السلبي الخطير بعد التطعيم هو اي حدث يهدد الحياة، أو يؤدي إلى الوفاة، أو الى الذهاب للمستشفى، أو إعاقة كبيرة أو تشوه خلقي 4. ومع ذلك لمجرد حدوث أي حدث سلبي بعد التطعيم فهذا لا يعني أنه مرتبط سببيًا باللقاح أو تصنيعه أو عملية برنامج التحصين أو إجراء التحصين ، فقد يكون حدثًا مصادفة (متزامنا مع التطعيم) أي حدث غير ذي صلة.
التجارب السريرية قبل الترخيص قادرة على الكشف عن الآثار الجانبية التي تحدث بعد التطعيم (أي تلك التي تحدث في 1٪ إلى 10٪ من المتلقين) مثل التهاب الذراع وضعف الشهية واحمرار الموقع الموضعي والحمى الخفيفة وما إلى ذلك. فبما أنها عادة ما تكون خفيفة أو تعتبر مشاكل محدودة فهي لا تعوق الموافقة على اللقاح من قبل الجهة المنظمة إذا لم يكن معدل الحدوث كبير. مايدعو الى الاطمئنان، أن بيانات التجارب السريرية قبل الترخيص للمرحلة الأولى والثانية والثالثة من لقاح mRNA ولقاح واحد من لقاح ناقلات فيروس الغدد والمتجهة نحو الموافقة عليها في العديد من البلدان اعتبارًا من ديسمبر 2020 لم تبلغ عن مخاوف خطيرة بشأن سلامة اللقاح وفقًا للتقارير المنشورة التي تمت مراجعتها من قبل المختصين 5و6. تضمنت الآثار الجانبية الشائعة ألمًا خفيفًا إلى متوسطًا في موقع الحقن، والتعب، والحمى الخفيفة (مثل لقاح mRNA المرشح في تجاربه في الولايات المتحدة). 7
– عدد المشاركين في هذه التجارب السريرية قبل الترخيص حتى لو كانت كبيرة نسبيًا مثل 30000 أو أكثر لا تزال غير كافية للكشف عن الأحداث السلبية الخطيرة النادرة جدًا، أي تلك التي تحدث في أقل من 0.01٪. يجب على مقدم الرعاية الصحية أن يتذكر أنه بالنسبة للقاحات الكوفيد-19 فإن هذه الآثار الخطيرة ولكن النادرة جدًا ستظل أقل شيوعًا من الأحداث الخطيرة بسبب مرض الكوفيد-19 نفسه، مثل مضاعفات الكوفيد والاستشفاء وحتى الوفاة بسبب الكوفيد-19. لا يمكن اكتشاف مثل هذه الأحداث السلبية الخطيرة والنادر جدًا بعد التطعيم إلا بعد الموافقة عليه، حيث يتم تطعيم الملايين. ومع ذلك، هناك تباين كبير بين البلدان في قدرتها على تنفيذ مراقبة سلامة اللقاحات بعد الموافقة عليها للتقصي عن الأحداث السلبية الخطيرة بعد التطعيم.
(https://www.who.int/vaccine_safety/publications/2019_Landscape_Analysis.pdf?ua=1).
– بغض النظر عن وجود نظام مراقبة سلبي فقط للتقصى عن الأحداث السلبية بعد التطعيم أو إذا كان هناك نظام مراقبة نشط يبحث بصورة روتينية عن إشارات السلامة11، فإن مقدمي الرعاية الصحية في الخطوط الأمامية يلعبون دورًا رئيسيًا في اكتشاف هذه الحالات وتنبيه جهات الصحة العامة إلى أن أحداث سلبية خطيرة قد حدثت. لا يحتاج جميع مقدمي الرعاية الصحية في الخطوط الأمامية فقط إلى معرفة كيفية الإبلاغ عن الأحداث السلبية الخطيرة بعد التطعيم في محيطهم وأيضًا يجب عليهم ان لا يقفزون إلى استنتاج مفاده أن اللقاح تسبب في حدوث هذه الآثار الخطيرة بعد اخذه. مثل هذا التحديد يجب أن يتم من قبل لجنة مستقلة في الدولة لتقييم العلاقة السببية.
((https://www.who.int/vaccine_safety/publications/CausalityAssessmentAEFI_EN.pdf?ua=1
تحدد هذه اللجنة باستخدام عملية مراجعة الحالات، ما إذا كان الحدث المبلغ عنه (تشخيص محدد) ناتجًا عن اللقاح، أو إلى خطأ في تصنيع اللقاح، أو خطأ في برنامج التحصين، أو استجابة متعلقة بضغوط التمنيع، أو كان حدثًا غير مرتبط (بمعنى قد حدث متزامنا مع التطعيم). طورت منظمة الصحة العالمية دليل مراقبة السلامة للقاحات الكوفيد-19 لمساعدة البلدان على تنفيذ هذه المهمة الهامة.
(https://www.who.int/vaccine_safety/committee/Module_Establishing_surveillance_systems.pdf?ua=1 ).
بالإضافة إلى الإبلاغ عن الأحداث السلبية الخطيرة بعد التطعيم، غالبًا ما يكون لدى مقدمي الرعاية الصحية علاقة مع المريض والأسرة مما يجعلهم في وضع جيد لإبلاغ الخطوات التي يتم اتخاذها للتأكد من الدور الذي لعبه أو لم يلعبه اللقاح في الأحداث السلبية الخطيرة بعد التطعيم. يجب التأكيد على أهمية عدم القفز إلى الاستنتاجات قبل الأوان. يجب أن يعمل برنامج الصحة العامة والتحصين جنبًا إلى جنب مع مسؤول الرعاية الصحية في الخطوط الأمامية لضمان التواصل السلس حيث يتم التحقيق في الأحداث السلبية الخطيرة بعد التطعيم وتقييم العلاقة السببية. 12
– يعد التعليم والتمكين والدعم للعاملين الصحيين من خلال برنامج التحصين في بلدهم أمرًا ضروريًا لتحقيق نتيجة إيجابية في الكشف عن الحالات المشتبه فيها لفشل لقاح الكوفيد-19 والإبلاغ عنها وأيضًا الأحداث السلبية الخطيرة بعد التطعيم فهي أساسية لتوسيع المعرفة حول فعالية وسلامة لقاحات الكوفيد-19 بعد الترخيص. يحتاج كل بلد إلى مشاركة النتائج التي توصلوا إليها حتى يمكن معرفة التقييم العالمي لفعالية لقاحات الكوفيد-19 المختلفة في أماكن مختلفة. يجب الإبلاغ عن الأحداث السلبية الخطيرة التي تم تقييمها من قبل لجنة تقييم علاقة السببية لربطها باللقاح أو تصنيعه أو خطأ في برنامج التحصين أو استجابة مرتبطة بضغط التحصين 13 إلى مركز مراقبة أوبسالا بالسويد التابع لبرنامج منظمة الصحة العالمية لمراقبة الأدوية الدولي بما في ذلك اللقاحات (https://www.who-umc.org/ ).
المراجع
- The estimation of diagnostic accuracy of tests for COVID-19:A scoping review. Axell-House DB, Lavingia R, Rafferty M, ClarkE, Amirian ES, Chiao EY. 2020, Journal of Infection, Vol. 81, pp. 681-697.
- Considerations for diagnostic COVID-19 tests. Vandenberg O, Martiny D, Rochas O et al. October 14, 2020, Nat Rev Microbiol.
- Assessing the Safety of COVID 19 Vaccines: A Primer. H, Petousis Harris. 2020, Drug Safety, Vol. 43, pp. 1205-1210.
- World Health Organization. Causality Assessment of an Adverse Event Following Immunizaiton (AEFI) user manual for the revised WHP classification. Geneva : World Health Organization, 2018.
- Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, Perez JL, Pérez Marc G, Moreira ED, Zerbini C, Bailey R, Swanson KA, Roychoudhury S, Koury K, Li P, Kalina WV, Cooper D, Frenck RW Jr, Hammitt LL, Türeci Ö, Nell H, Schaefer A, Ünal S, et. December 10, 2020, N Engl J Med.
- Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, Angus B, Baillie VL, Barnabas SL, Bhorat QE, Bibi S, Briner C, Cicconi P, Collins AM, Colin-Jones R, Cutland CL, Darton TC, Dheda K, Duncan CJA, Emary KRW, Ewer KJ, Fairlie L, et al. Dec 8, 2020, Lancet, pp. S0140-6736(20)32661-1.
- Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates. Walsh EE, Frenck RW Jr, Falsey AR, Kitchin N, Absalon J, Gurtman A, Lockhart S, Neuzil K, Mulligan MJ, Bailey R, Swanson KA, Li P, Koury K, Kalina W, Cooper D, Fontes-Garfias C, Shi PY, Türeci Ö, Tompkins KR, Lyke KE, Raabe V, Dormitzer PR, Jansen KU,etal. Oct 14, 2020, N Engl J Med.
- Three-month Follow-up Study of Survivors of Coronavirus Disease 2019 after Discharge. Liang L, Yang B, Jiang N, Fu W, He X, Zhou Y, Ma WL, Wang X. 47, 2020, J Korean Med Sci, Vol. 35, p. e418.
- Price-Haywood EG, Hospitalization and Mortality among Black Patients and White Patients with Covid-19. Price-Haywood EG, Burton J, Fort D, Seoane L. 26, 2020, N Engl J Med., Vol. 382, pp. 2534-2543.
- Prevalence and predictors of death and severe disease in patients hospitalized due to COVID-19: A comprehensive systematic review and meta-analysis of 77 studies and 38,000 patients. Dorjee K, Kim H, Bonomo E, Dolma R. 12, 2020, PLoS One, Vol. 15, p. e0243191.
- Optimizing safety surveillance for COVID-19 vaccines. RE, Chandler. 8, 2020, Nature reviews. Immunology, Vol. 20, pp. 451-2.
- Lessons on causality assessment and communications from the 2019 South-East Asia Regional (SEAR) workshop on inter-country expert review of selected Adverse Events Following Immunization (AEFI) cases. MacDonald NE, Guichard S, Arora N, Menning L, Wilhelm E,2019 Inter-country SEAR Workshop Participants, Communication Experts. 32, 2020, Vaccine, Vol. 38, pp. 4924-4932.
- Immunization stress-related response – Redefining immunization anxiety-related reaction as an adverse event following immunization. Gold MS, MacDonald NE, McMurtry MC, Balakrishnan MR, Heininger U, Menning L, Benes O, Pless R, Zuber PLF. 14, 2020, Vaccine, Vol. 38, pp. 3015-3020.
سونالي كوشهار(Sonali Kochhar) وفريق سؤال وجواب
التطعيم هو أحد أنجح تدابير الصحة العامة للوقاية من الأمراض. 1 تُعطى اللقاحات للأشخاص الأصحاء، بمن فيهم الأطفال الصغار جدًا والأشخاص المعرضون للخطر، وبالتالي فإن المستوى المقبول للمخاطر من اللقاحات منخفض جدًا. من الضروري أن تتمتع اللقاحات بتوازن جيد للغاية بين الفوائد والمخاطر، أي يجب أن تكون فوائد التطعيم أكبر بكثير عند مقارنتها بأي خطر للضرر. 2
تقييم الفوائد و المخاطر هو أساس القرارات المنظمة لجميع اللقاحات والأدوية قبل و بعد عمليات مراجعة الترخيص. 2,3 لا يُمنح الترخيص باستخدام اللقاح أو تعاطي الأدوية إلا إذا أظهر تقييم الفوائد و المخاطر وجود توازن إيجابي كافٍ بين الفوائد والمخاطر بناءً على الأدلة العلمية.
قد يختلف تقييم الفوائد و المخاطر للقاح أو الدواء بالنسبة لفئات المجتمع المختلفة (على سبيل المثال ، الأطفال ، والنساء الحوامل ، والأشخاص الذين يعانون من نقص المناعة) ، وللأشخاص المعرضين لخطر الإصابة بالأمراض المرتفعة مقابل المنخفضة (مثل العيش في منطقة بها تفشي وباء نشط) . 3
يأخذ تقييم الفوائد والمخاطر في الاعتبار عددًا من العوامل بما في ذلك شدة المرض ، ومدى جودة الأدوية المتوفرة حاليًا للمرض لتلبية الاحتياجات الطبية للسكان ، وفعالية اللقاح في الوقاية من المرض في مجموعات سكانية محددة ، وخطر الآثار السلبية بعد التطعيم لنفس السكان مقارنة بالمخاطر المرتبطة بالمرض. 2,3,4
فعلى سبيل المثال بالنسبة للقاح الحصبة، فإن فائدة اللقاحات تفوق بكثير المخاطر (يجب مقارنة مخاطر الأحداث السلبية بعد التطعيم بالمخاطر المرتبطة بالمرض. كما تؤخذ في الاعتبار مخاطر الآثار الجانبية للعلاج المستخدم للتخفيف من أعراض المرض). 5
تقييم الفوائد والمخاطر للقاح الحصبة 5
(يتم مقارنة مخاطر الأحداث السلبية بعد التطعيم بالمخاطر المرتبطة بالمرض وخطر الآثار الجانبية للعلاج المستخدم للتخفيف من أعراض المرض)

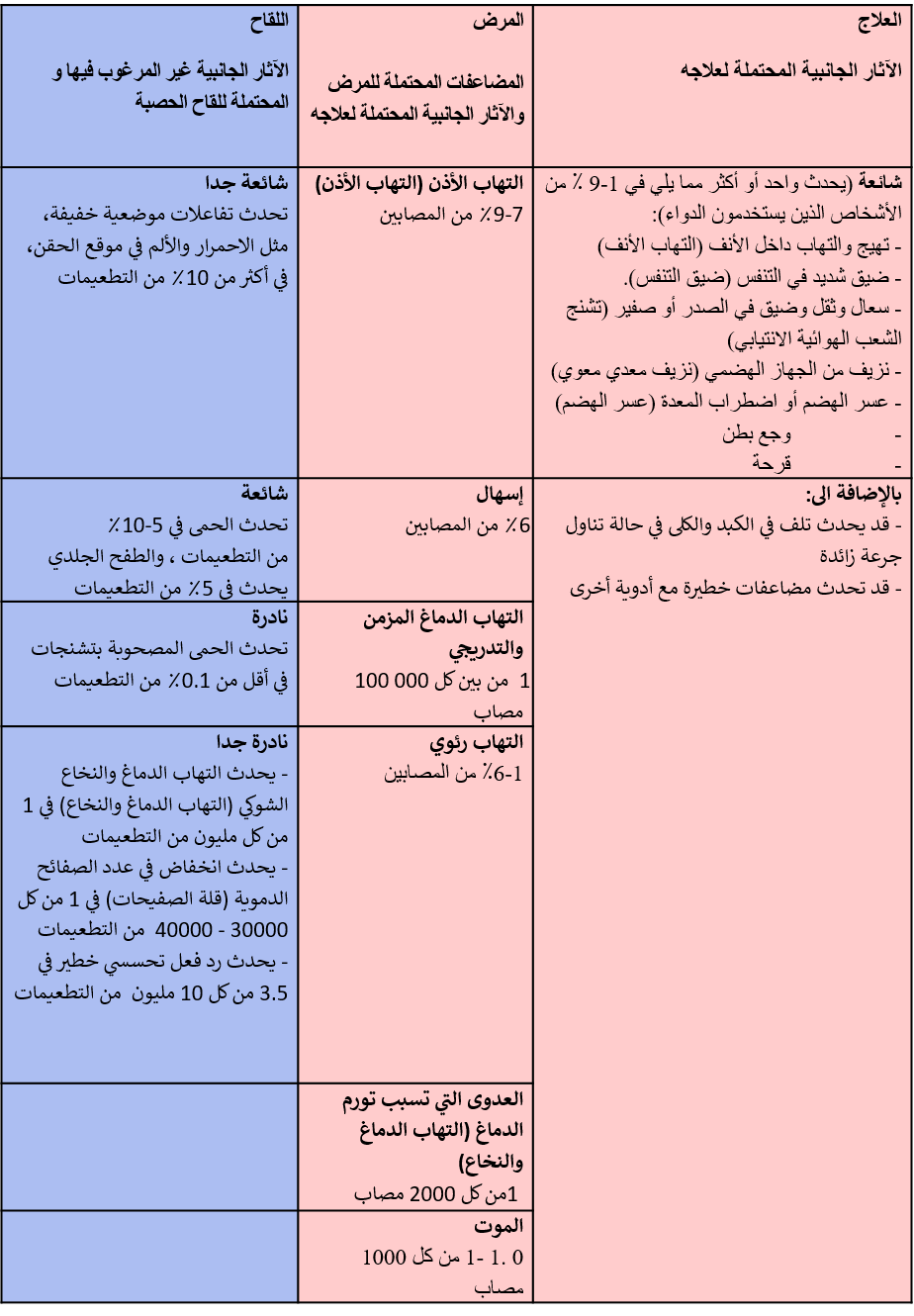
المراجع
- Rémy V, Zöllner Y, Heckmann U. Vaccination: the cornerstone of an efficient healthcare system. J Mark Access Health Policy. 2015;3:10.3402/jmahp.v3.27041. doi:10.3402/jmahp.v3.27041
- Arlegui, H., Bollaerts, K., Salvo, F. et al. Benefit–Risk Assessment of Vaccines. Part I: A Systematic Review to Identify and Describe Studies About Quantitative Benefit–Risk Models Applied to Vaccines. Drug Saf (2020). https://doi.org/10.1007/s40264-020-00984-7
- Benefit-risk assessment in drug regulatory decision-making. Draft PDUFA VI Implementation Plan (FY 2018-2022). FDA. March 30, 2018. Accessed on Sept 30, 2020 at https://www.fda.gov/media/112570/download
- Curtin F, Schulz P. Assessing the benefit: risk ratio of a drug–randomized and naturalistic evidence. Dialogues Clin Neurosci. 2011;13(2):183-90. PMID: 21842615; PMCID: PMC3181998.
- Risk scales : benefits of vaccines far outweigh the risks. WHO Europe. Accessed on Oct 9, 2020 at https://www.euro.who.int/en/health-topics/disease-prevention/vaccines-and-immunization/publications/2017/risk-scales-benefits-of-vaccines-far-outweigh-the-risks-2017
يونقمي جي (Youngmee Jee) وفريق سؤال وجواب
الآثار الجانبية المتعلقة باللقاح هي أي مشكلة صحية تبين الدراسات أن اللقاح يسببها. بينما الأحداث السلبية هي أي مشاكل صحية تحدث بعد التطعيم قد تكون مصادفة أو مرتبطة باللقاح.ليس لدينا بيانات تجريبية كافية حتى الآن لنقول ما ستكون عليه الأحداث السلبية الطفيفة والخطيرة مع لقاحات الكوفيد-19 الجديدة. ومع ذلك ، فنحن على علم بالأحداث السلبية للأنواع الأخرى من اللقاحات التي تحقن.
- يمكن أن تكون الآثار الجانبية البسيطة الشائعة هي الألم في موقع الحقن ، والاحمرار / التورم في موقع الحقن ، وحمى خفيفة، والتعب ، والصداع ، وآلام العضلات و / أو المفاصل الطفيفة (انظر الجدول 1) . 1 وعادة ما تحدث هذه الآثار الجانبية الطفيفة في غضون ساعات قليلة من الحقن ولكنها سوف تزول في غضون أيام قليلة.
- الآثار الجانبية الشديدة مثل التشنجات، قلة الصفائح الدموية، البكاء لفترات طويلة يمكن أن يحدث بشكل نادر ولكنها عادة لا تؤدي إلى مشاكل طويلة الأمد1 .
- ردود الفعل التحسسية مثل الحساسية المفرطة حدوثها نادر جدا ولكنها يمكن أن تحدث على الفور (عادة في غضون دقائق) بعد التطعيم (على سبيل المثال ، بسبب أحد مكونات اللقاح مثل نيومايسين) ويمكن أن تكون مهددة للحياة. يجب أن يكون مقدمو الرعاية الصحية مستعدين لعلاج أعراض الحساسية المفرطة.
- يمكن تصنيف الأحداث السلبية للقاح إلى 5 فئات:
- ;رد فعل مرتبط بمنتج أو أحد مكونات اللقاح
- ;رد فعل مرتبط بجودة اللقاح
- ;رد فعل مرتبط بخطأ في التطعيم
- ;رد فعل مرتبط بالإجهاد من التطعيم
- ;حدث عرضي متزامن مع التطعيم . 1
- تعتبر الأحداث السلبية بعد التطعيم خطيرة إذا نتجت عنها الوفاة، أو مما تهدد الحياة، أو مما تتطلب دخول المستشفى أو إطالة فترة الاستشفاء الحالية، أو وجود عجز / عجز مستمر أو كبير، أو تشوه خلقي / عيب خلقي أو يتطلب تدخلاً للوقاية من ضعف من الضرر. يتم توفير المعدلات المتوقعة للتأثير الضار بعد التطعيم بعد بعض لقاحات الطفولة على https://vaccine-safety-training.org/ . 1
- ; أظهرت بيانات السلامة من تجارب المرحلة الثالثة من لقاح الكوفيد-19 التابع لشركة فايزر 2 أن الآثار الجانبية الشائعة مثل الصداع والقشعريرة وآلام المفاصل والإسهال كانت بين الفئات العمرية الأكبر أقل من الفئات العمرية الأصغر. كانت معظم الأعراض الجانبية بعد الجرعة الثانية خفيفة إلى معتدلة .سيتم تقييم جميع البيانات بعناية من قبل الهيئات المنظمة في إصدار قرارهم بشأن الموافقة على اللقاح للإستخدام أم لا.
- لقاح الكوفيد-19 التابع لشركة موديرنا أظهر أيضًا آثارًا جانبية شائعة طفيفة.3 وتجدر الإشارة إلى أن الأحداث السلبية الجهازية كانت أكثر شيوعًا بعد الجرعة الثانية وفي أولئك الذين يتلقون أعلى جرعة.
- لقاحات الكوفيد-19التي أكملت تجارب المرحلة الثالثة والتي أجريت على 20000 فرد أو أكثر، أثبتت وجود عدد قليل جدًا من الآثار السلبية الخطيرة أو لم تكن لها آثار سلبية خطيرة ، ومن المرجح أن تحصل على الموافقة للاستخدام من الهيئات المنظمة . 4
الجدول 1. تفاعلات اللقاح الشائعة والطفيفة والعلاج
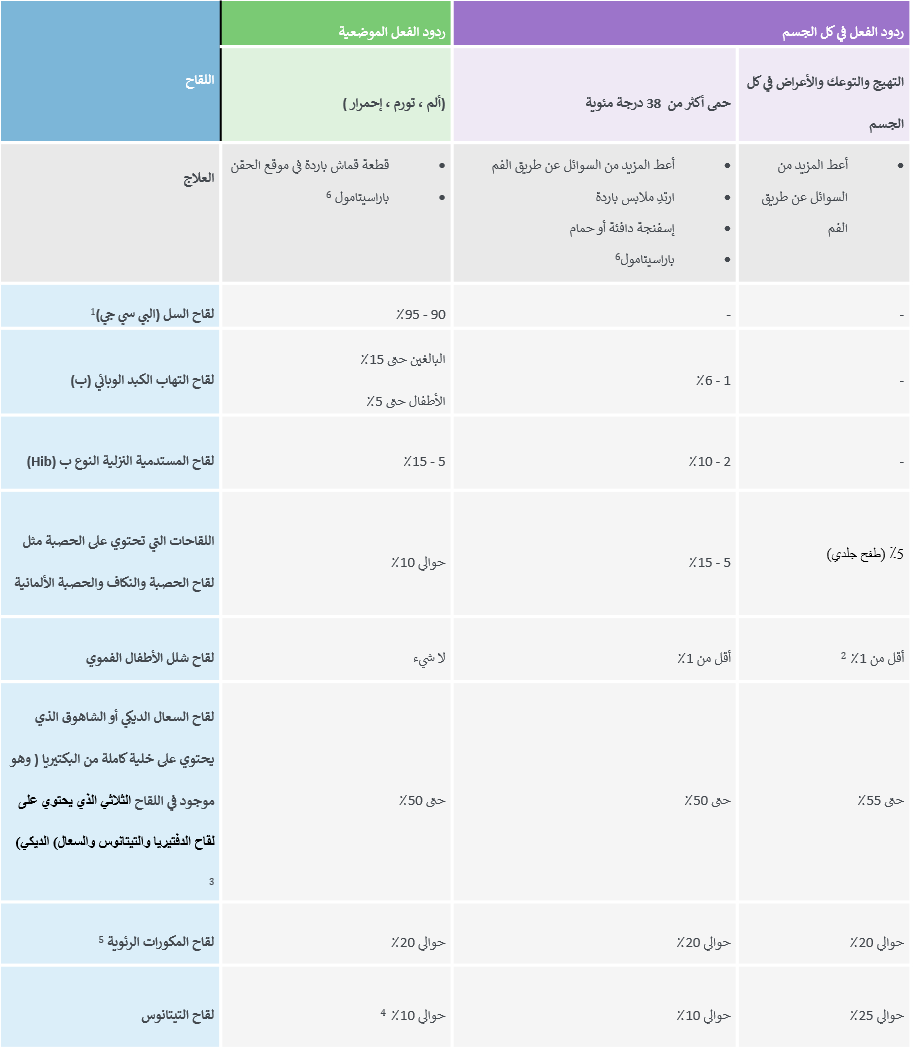
2. الإسهال والصداع و / أو آلام العضلات.
3. عند مقارنة لقاح السعال الديكي (الشاهوق) الذي يحتوي على خلية كاملة ، فان معدلات التفاعلات في لقاح السعال الديكي اللاخلوي تكون أقل.
4. من المحتمل أن يزداد معدل التفاعلات الموضعية مع الجرعات المنشطة ، حتى 50 – 85٪.
5. المصدر: http://www.cdc.gov/vaccines/hcp/acip-recs/
6. جرعة الباراسيتامول: تصل إلى 15 مجم / كجم كل 6-8 ساعات بحد أقصى 4 جرعات في 24 ساعة.
المصدر: WHO Vaccine safety basics e-learning course (module 3: Adverse events following immunization)
المراجع
WHO vaccine safety basics e-learning course. Accessed on 18 Oct 2020 at https://vaccine-safety-training.org/
Pfizer says Covid-19 vaccine showed moderate side effects. Accessed on
https://www.clinicaltrialsarena.com/news/pfizer-covid-vaccine-tolerability-data/Anderson EJ, Rouphael NG, Widge AT, Jackson LA, Roberts PC et al. Safety and Immunogenicity of SARS-CoV-2 mRNA-1273 Vaccine in Older Adults. N Engl J Med. 2020 Sep 29. doi: 10.1056/NEJMoa2028436.
Grech V, Calleja N. Theoretical novel COVID-19 vaccination risk of rare and severe adverse events versus COVID-19 mortality. Early Hum Dev. 2020 Oct 1:105212. doi: 10.1016/j.earlhumdev.2020.105212.
نوني ماكدونالد (Noni MacDonald) ولجنة أسئلة وأجوبة
تسمى الآثار الجانبية بالأحداث السلبية – وتلك التي تلي التطعيم ، بالأحداث السلبية بعد التطعيم وهي:
“أي حدث طبي غير مرغوب فيه عقب التطعيم وليس بالضرورة أن يكون له علاقة سببية باستخدام اللقاح. قد يكون الحدث السلبي عبارة عن أي علامة غير مناسبة أو غير مقصودة أو اكتشافات مختبرية غير طبيعية أو أعراض أو مرض.” 1
تحدث الآثار السلبية الشائعة والطفيفة للأنواع مختلفة من التطعيمات بما في ذلك العلامات والأعراض مثل الحمى ذات درجة الحرارة المنخفضة وآلام العضلات، آلام الجسم، ألم موضعي، احمرار و / أو تورم في مكان الحقن، عادة في أقل من 20٪ من المتلقين للقاح في غضون ساعات قليلة من الحقن، يتم زوالها بعد فترة زمنية قصيرة وليس لها عواقب طويلة المدي. يخضع أي لقاح جديد مثل لقاحات الكوفيد-19 الى الرقابة لتحديد ما إذا كانت الآثار السلبية الطفيفة تحدث بمعدل مماثل كما هو مذكور في التجارب السريرية وما إذا كانت هذه الآثار السلبية الثانوية أكثر شيوعًا في الفئات العمرية المختلفة أو عند أولئك الذين لديهم أسباب مختلفة. أي بمعنى المعلومات التي قد لا تكون متاحة من التجارب السريرية للقاح.
ستكون شدة الاثار الجانبية بشكل عام خفيفة ونادرًا ما تكون متوسطة أو شديدة (مثل حمى خفيفة أو معتدلة). لا تؤدي الأحداث السلبية الخطيرة بعد التطعيم بالضرورة إلى مشاكل طويلة الأمد.
الأحداث السلبية بعد التطعيم التي يجب أن تلفت الانتباه بسرعة هي الأثار “الخطيرة”. “الأحداث السلبية الخطيرة بعد التطعيم هي التي تؤدي إلى الوفاة ، أو تهدد الحياة ، أو تتطلب دخول المستشفى أو إطالة فترة الاستشفاء الحالية ، أو تؤدي إلى إعاقة / عجز مستمر أو كبير ، أو تشوه خلقي / عيب خلقي ، أو يتطلب تدخلاً للوقاية من ضعف أو ضرر دائم.”1
عادة لا يتم اكتشاف الأحداث السلبية بعد التطعيم في التجارب السريرية لأنها نادرة جدًا، أي تحدث في أقل من 1 من كل 10000 متلقي للقاح. النقطة الحاسمة في الأحداث السلبية بعد التطعيم الخطيرة هي تحديد ما إذا كانت هذه الأحداث السلبية ناتجة عن اللقاح نفسه ، أي التفاعل المرتبط بمنتج اللقاح ؛ أو هو تفاعل مرتبط بعيب في جودة اللقاح ، أي مشكلة في تصنيع اللقاح ؛ أو هو خطأ في برنامج التطعيم؛ رد فعل مرتبط بخطأ التطعيم أي بمعنى خطأ في البرنامج مثل أن يكون تخزين اللقاح غير لائق، أو إستخدام مادة مخففة خاطئة، وما إلى ذلك؛ أو تفاعل مرتبط بضغوط التحصين، أو أي حدث عرضي بمعنى أن يكون متزامن مع حدث آخر. 1,2
غالبًا ما تكون الأحداث مصادفة(متزامنة مع احداث اخرى). مع الملاحظة أنه إذا ما كانت الأحداث السلبية الخطيرة بعد التطعيم مرتبطة بالفعل باللقاح ، فقد يتم اتخاذ إجراء تصحيحي ، أي سحب اللقاح. ومع ذلك، نظرا إلى دقة وصرامة عملية الموافقة المسبقة على اللقاح ، و دقة عملية الموافقة عليه ، بالإضافة إلى الجودة العالية للتصنيع ، نادرًا ما يكون اللقاح هو المشكلة في حدوث أحداث سلبية خطيرة.
يلعب العاملون في مجال الرعاية الصحية العديد من الأدوار المهمة جدًا فيما يتعلق بالأحداث السلبية بعد التطعيم:
أ) التعرف على الأحداث السلبية الخطيرة وكذلك الطفيفة التي قد تحدث بعد التطعيم والإبلاغ عنها ، إذا طُلب منهم ذلك،
ب) توفير الرعاية للمريض المصاب بالأحداث السلبية بعد التطعيم ؛
ج) المساعدة في جمع معلومات الحالة التي ستحتاجها لجنة تقييم السببية لتحديد ما إذا كانت بالأحداث السلبية بعد التطعيم مرتبطة باللقاح أم لا ؛ 3
د) المحافظة على الموضوعية في الوصول إلى أي استنتاج حول سبب الأحداث السلبية بعد التطعيم.
هـ) ايصال البيانات بطريقة فعالة، ومحترمة وفي الوقت المناسب، ومبنية على الحقائق المعروفة للحدث . يجب أيضًا أن يكون برنامج الصحة العامة المحلي جاهزا للتواصل بشأن الحدث والخطوات التي يتم اتخاذها للتحقيق وإثبات العلاقة السببية . 3,4 العمل معهم ومع مؤسستك لضمان توفير معلومات دقيقة. تأكد من التحقق من صحة المعلومات وعدم تناقل أي معلومات خاطئة.
المراجع
World Health Organization. Vaccine Safety Basics e-learning course. Module 3. Adverse events following immunization. https://vaccine-safety-training.org/vaccine-reactions.html. Accessed Sept 24,2020
Gold MS, MacDonald NE, McMurtry CM, Balakrishnan MR, Heininger U, Menning L, Benes O, Pless R, Zuber PLF. Immunization stress-related response – Redefining immunization anxiety-related reaction as an adverse event following immunization. Vaccine. 2020; 38(14):3015-3020.
World Health Organization. Vaccine Safety Basics e learning course. Module 4: Surveillance. Causality Assessment of AEFIs. https://vaccine-safety-training.org/causality-assessment-of-aefis.html. Assessed Sept 24, 2020
World Health Organization EUROPE. Crisis Communication Template (2017). https://www.euro.who.int/en/health-topics/disease-prevention/vaccines-and-immunization/publications/2017/crisis-communications-plan-template-2017. Accessed Sept 24, 2020
سونالي كوشهار(Sonali Kochhar) وفريق سؤال وجواب
هناك دليل على أن النساء الحوامل قد يتعرضن لخطر متزايد للإصابة بأمراض خطيرة من جراء الاصابة بالكوفيد-19. 1,2,3 وقد يكون هناك خطر متزايد من حدوث نتائج سلبية للحمل والولادة أيضًا. لا توجد بيانات حتى الآن بشأن ما إذا كانت لقاحات الكوفيد-19 آمنة أو فعالة في النساء الحوامل حيث تم استبعادهن من التجارب السريرية. من المهم أن يتم إنشاء البيانات الخاصة بالنساء الحوامل عندما يتم تضمينهن في التجارب السريرية في مرحلة لاحقة من دراسات السلامة الخاصة بالحمل ومتابعة النساء المشاركات في التجربة واللاتي قد حملن عن غير قصد خلال المرحلة الثالثة من التجارب السريرية لإرشاد توصيات الصحة العامة لإستخدام لقاح الكوفيد-19 في هذه الفئة من السكان.3,4
المراجع
Allotey J, Stallings E, Bonet M, Yap M, Chatterjee S et al for PregCOV-19 Living Systematic Review Consortium. Clinical manifestations, risk factors, and maternal and perinatal outcomes of coronavirus disease 2019 in pregnancy: living systematic review and meta-analysis. BMJ. 2020 Sep 1;370:m3320. doi: 10.1136/bmj.m3320.
Ellington S, Strid P, Tong VT, Woodworth K, Galang RR, Zambrano LD, Nahabedian J, Anderson K, Gilboa SM. Characteristics of Women of Reproductive Age with Laboratory-Confirmed SARS-CoV-2 Infection by Pregnancy Status – United States, January 22-June 7, 2020. MMWR Morb Mortal Wkly Rep. 2020 Jun 26;69(25):769-775. doi: 10.15585/mmwr.mm6925a1. PMID: 32584795; PMCID: PMC7316319.
Dashraath P, Nielsen-Saines K, Madhi SA, Baud D. COVID-19 vaccines and neglected pregnancy. Lancet. 2020 Sep 5;396(10252):e22. doi: 10.1016/S0140-6736(20)31822-5
Heath PT, Le Doare K, Khalil A. Inclusion of pregnant women in COVID-19 vaccine development. Lancet Infect Dis. 2020 Sep;20(9):1007-1008. doi: 10.1016/S1473-3099(20)30638-1
كارينا توب (Karina Top) وفريق سؤال وجواب
تتم مراقبة جميع اللقاحات المعتمدة للاستخدام من قبل السلطات المنظمة الوطنية (مثل إدارة الغذاء والدواء الأمريكية أو وزارة الصحة الكندية) للتأكد من سلامتها وفعاليتها بعد البدء في استخدامها بواسطة السكان. كحد أدنى ، يُنصح البلدان بتنفيذ أنظمة المراقبة والتقصي السلبية التي تجمع التقارير الفردية عن الأحداث السلبية بعد التطعيم من مقدمي الرعاية الصحية ومصنعي اللقاحات وعامة الناس غالبًا. 1 يتم تجميع هذه التقارير وتحليلها لتحديد أي أنماط قد تشير إلى وجود مخاوف تتعلق بالسلامة في اللقاح (على سبيل المثال ، حالة معينة يتم الإبلاغ عنها في كثير من الأحيان بعد لقاح محدد أكثر مما هو متوقع بناءً على المعدل المعروف لهذه الحالة وسط السكان). يوصى أيضًا البلدان التي لديها القدرة على إنشاء أنظمة مراقبة نشطة للبحث عن حالات الأحداث السلبية ذات الأهمية الخاصة(على سبيل المثال ، التشنجات ، متلازمة غيلان باريه بعد التطعيم ومقارنة معدلات هذه الحالات بين المجموعات التي تم تطعيمها والتي لم يتم تطعيمها لتحديد ما إذا كان هذه الأحداث السلبية قد حدثت بالصدفة (وهو أمر شائع) أو كانت مرتبطة باللقاح.
كما هو الحال مع أي لقاح جديد، سيتم تعزيز أنظمة المراقبة السلبية والنشطة لتحديد أحداث سلبية معينة ذات أهمية خاصة بعد التطعيم بلقاحات الكوفيد-19 في الوقت المناسب. تعمل منظمات الصحة العامة الوطنية والدولية بالفعل على تطوير مبادئ توجيهية واستراتيجيات لضمان مراقبة قوية لسلامة لقاحات الكوفيد-19 بعد نزولها الى السوق. تعمل اللجنة الاستشارية العالمية التابعة لمنظمة الصحة العالمية والمعنية بسلامة اللقاحات مع تعاون برايتون، وهو اتحاد دولي لخبراء سلامة اللقاحات ، بالتعاون مع التحالف من أجل ابتكارات التأهب للأوبئة ، على تطوير مبادئ توجيهية وتعريفات للحالات
لمراقبة سلامة لقاحات الكوفيد-19 (من المتوقع أن يكون متاحًا على الإنترنت في ديسمبر 2020). 2
المراجع
Department of Immunization, Vaccines and Biologicals. 2012. Global Vaccine Safety Blueprint. Geneva: World Health Organization. Access at: https://www.who.int/vaccine_safety/publications/en/. Accessed: 5 October 2020.
2020. Global Advisory Committee on Vaccine Safety, 27-28 May 2020. Wkly Epidemiol Rec. 95:325-336. Access at: https://apps.who.int/iris/bitstream/handle/10665/333136/WER9528-eng-fre.pdf?ua=1. Accessed: 5 October 2020.
سونالي كوشهار(Sonali Kochhar) وفريق سؤال وجواب
لا توجد هناك أية بيانات من التجارب السريرية لدعم استبدال الجرعة الثانية من اللقاح بلقاح آخر لـلكوفيد-19. يوصى بالـتأكد من تفاصيل اللقاح قبل التطعيم لضمان إعطاء اللقاح الصحيح.
تعريف بمجموعة العمل وأعضائها الذين قاموا باعداد هذه الأسئلة والأجوبة
تقديرا للأهمية البالغة للقاحات الكوفيد-19 والحاجة إلى فهم سلامتها، تم إنشاء مجموعة عمل (CONSIDER WG) وهي اختصار باللغة الانجليزية ويعني (أسئلة وأجوبة حول سلامة لقاحات الكوفيد-19 لمقدمي خدمات الرعاية الصحية). هذه المجموعة تم إنشاؤها في سبتمبر 2020.
يهدف CONSIDER WG إلى تقديم إجابات واضحة وشاملة للأسئلة المتعلقة بسلامة لقاحات الكوفيد-19 قبل وأثناء طرح اللقاحات من أجل: 1) تسهيل المناقشة العلمية بين أصحاب المصلحة، بما في ذلك العاملين الصحيين في الخطوط الأمامية مع متلقي اللقاح المحتملين و 2) زيادة فهم وشفافية المعلومات لتسهيل القبول والاستيعاب.
من المحتمل أن تكون هناك مخاوف مرتبطة بلقاحات الكوفيد-19 نظرًا لتسارع وتيرة تطوير اللقاحات، وانعدام الثقة في الاستجابة الوبائية من قبل الحكومات والشكوك المتزايدة بشأن اللقاحات في بعض المجموعات السكانية . 1-4
فكما هو معروف بالنسبة لجميع اللقاحات الجديدة، فهناك احتمال أن لا يتم تحديد ردود الفعل السلبية النادرة في التجارب السريرية ولن يتم اكتشافها إلا بعد تطعيم عدد كبير من الأشخاص. بالإضافة إلى ذلك، عند تطعيم عدد كبير من الناس، سيكون لبعضهم نتائج صحية سلبية بعد التطعيم بفترة وجيزة عن طريق الصدفة وحدها. يجب معالجة مخاوف سلامة لقاح الكوفيد-19 بشكل عاجل. تم تطوير مجموعة CONSIDER لتقديم إجابات لأسئلة سلامة لقاح الكوفيد-19 الشائعة والتي يمكن فهمها والوصول إليها من قبل أصحاب المصلحة الرئيسيين.
تتم كتابة كل إجابة بواسطة عضو خبير في مجموعة العمل ومراجعتها من قبل عضوين آخرين أو أكثر.
. العلم يتطور بسرعة. عندما يسترعي انتباه المجموعة الى المزيد من الأسئلة أو توفر المزيد من المعلومات (من التجارب السريرية للقاح الكوفيد-19 والتجربة المبكرة لإدخال اللقاح في البلدان) سيتم تحديث الإجابات ونشر إجابات جديدة. والأجوبة مستضافة على هذه الصفحة ويتم الأسئلة و الرجوع إليها في مواقع أخرى مثل موقع مبادرة تطعيم. المعلومات الواردة في هذه الصفحة مكتوبة من قبل مجموعة دولية من الخبراء في التحصين وهي قابلة للتطبيق على الصعيد العالمي، بما في ذلك في السياق الكندي والسوداني. يوجد أدناه أحدث إصدار من الإجابات. سيتم تحديث صفحة الويب هذه عند إضافة إجابات جديدة. تمت ترجمة هذه الأسئلة من اللغة الإنجليزية الى اللغة العربية بواسطة مبادرة تطعيم بجامعة الأحفاد في السودان بطلب من شبكة سلامة اللقاحات التابعة لمنظمة الصحة العالمية لصالح موقع كنافاكس الكندي
المراجع
- Schaffer DeRoo S, Pudalov NJ, Fu LY. Planning for a COVID-19 Vaccination Program. JAMA. 2020; 323(24):2458-2459. doi:10.1001/jama.2020.8711
- Lancet COVID-19 Commissioners, Task Force Chairs, and Commission Secretariat. Lancet COVID-19 Commission Statement on the occasion of the 75th session of the UN General Assembly. Lancet. 2020:S0140-6736(20)31927-9. doi: 10.1016/S0140-6736(20)31927-9.
- Kochhar S, Salmon DA. Planning for COVID-19 vaccines safety surveillance. Vaccine. 2020 Sep 11;38(40):6194-6198. doi: 10.1016/j.vaccine.2020.07.013
4. MacDonald NE, Dube E. Vaccine safety concerns: Should we be changing the way we support immunization? EClinicalMedicine. 2020 Jun; 23:100402. doi: 10.1016/j.eclinm.2020.100402.
Clinical Associate Professor, Department of Global Health, University of Washington, Seattle; Medical Director, Global Healthcare Consulting
COI – Nothing to declareSenior researcher at Quebec National Institute of Public Health; Invited Professor in Anthropology, Laval University, Canada
COI – Nothing to declareUniversity Research Professor and Professor of Pediatrics (Infectious Diseases) and Anthropology, Dalhousie University, Canada
COI – Nothing to declareVisiting Professor, GSPA, Seoul National University; Special Representative for Health Diplomacy, Korea Foundation
COI – Nothing to declareSenior Infectious Disease Consultant, Director Research and Innovation Center, King Saud Medical City, Ministry of Health, Riyadh, Saudi Arabia
COI- Nothing to declareTechnical Officer, WHO HQ Department of Immunization, Vaccines, and Biologicals, Geneva
COI – Nothing to declareChief Physician, Deputy Head of Unit, Finnish Institute for Health and Welfare THL, Finland
COI – My institute THL has got a strategy of public private partnership; neither myself nor my unit receives such private funds/grants.Director and Professor, Institute for Vaccine Safety, Johns Hopkins University School of Public Health, United States
COI – Consulting and/or grants with Merck, Jenssen and Walgreens.Associate Professor of Pediatrics and Community Health & Epidemiology, Dalhousie University, Canada
COI – In the past 3 years I have received consultancy fees from Pfizer and grants from GSK to my institution for projects unrelated to this work.Professor Paediatrics, Dalhousie University, IWK Health Centre, Canada
COI- Nothing to declare
:تم تحديث الصفحة بواسطة فريق مبادرة تطعيم
الأربعاء 3 مارس 2021
